유전자 활성
억제 동시 조절 가능한 합성생물학 핵심 기술, 박테리아 유전자 조절 한계 극복
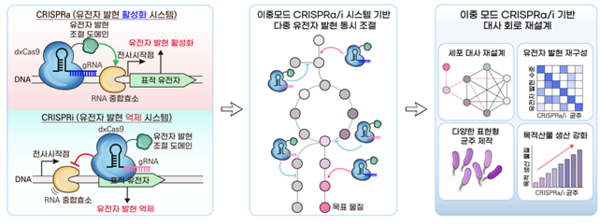
KAIST는 공학생물학대학원 이주영 교수와 한국화학연구원 노명현 박사 공동연구팀이 대장균에서 원하는 유전자를 동시에 켜고 끄는 ‘이중모드 크리스퍼(CRISPR) 유전자 가위 시스템’을 개발했다고 21일 밝혔다.
합성생물학의 핵심은 생명체의 유전자 회로를 프로그래밍하듯 설계해 원하는 기능을 수행하도록 만드는 것이다. 전자회로에서 스위치를 켜고 끄듯, 특정 유전자는 활성화하고 다른 유전자는 억제해 대사경로를 최적화하는 기술이 필요하다. 연구팀이 개발한 이중모드 유전자 가위는 바로 이러한 정밀한 유전자 조절을 가능하게 하는 핵심 도구다.
기존 유전자 가위(CRISPR)는 주로 ‘끄기(억제)’ 기능에 특화된 유전자 발현을 막는 데는 뛰어났지만, 반대로 유전자를 켜는 기능은 매우 제한적이었다.
또한 크리스퍼 유전자 가위가 작동하려면 특정 DNA 인식 서열(PAM, protospacer adjacent motif)이 필요한데, 기존 시스템은 PAM 인식 범위가 좁아 조절할 수 있는 유전자의 폭이 제한적이었다.특히 박테리아에서는 내부 전사조절 메커니즘 차이로 유전자 ‘켜기’가 제대로 작동하지 않는 한계가 있었다.
연구팀은 이를 극복하고자 표적을 확장해 더 많은 유전자에 접근 가능하도록 하고 대장균 단백질을 활용. 유전자 활성화 성능을 대폭 향상했다.
유전자를 켜는 실험에서는 최대 4.9배까지 발현량이 증가했고, 끄는 실험에서는 83%까지 억제할 수 있었다. 특히 두 개의 서로 다른 유전자를 동시에 조절할 수 있다는 장점이었다. 실제로 한 유전자는 8.6배 활성화하면서 동시에 다른 유전자는 90% 억제하는 데 성공했다.
연구팀이 개발한 유전자 가위는 합성생물학 기반 바이오산업 발전에 크게 기여할 것으로 기대를 모으고 있다.
이주영 교수는 “이번 연구는 유전자 가위와 합성생물학을 결합해 미생물 생산 플랫폼의 효율을 크게 높인 성과”라며 “하나의 시스템으로 복잡한 유전자 네트워크를 제어할 수 있어 새로운 연구 패러다임을 제시했다”고 밝혔다.
한편 이번 연구 결과는 분자생물학 분야 최고 권위지인 ‘핵산연구학술지(Nucleic Acids Research)’에 지난달 21일 온라인 게재됐다.
김형중 기자 kimhj@ggilbo.com